材料学导论
概论
迄今为止,一切人类社会发展的历史都可视作是人类利用工具的历史;而人类利用工具的历史,则又可看作是材料发展的历史。 现今得到大量利用的材料可分为三种:无机非金属材料、金属材料和有机高分子材料;而这三种材料的性质又是尤其结构决定的。
- 无机非金属材料一般不具有晶体结构,在小尺度上有序而在大尺度上无序,变形时不存在化学键的阻碍,因此难以变形而只能断裂。典型的无机非金属材料有水泥、陶瓷、玻璃等。
- 金属材料具有晶体结构,原子之间以金属键连接。电子能够在金属晶体中较自由的运动,这使得金属材料能够在一定程度上变形,从而具有较好的延展性。典型的金属材料如青铜(铜、锡、铅合金)。
- 有机高分子材料中具有两种键:聚合形成链上的共价键和链之间的分子间作用力(也称分子键),这两种键使得高分子材料具有独特的性质。
无机非金属材料抗酸、有机溶剂与高温,但是抗碱、抗冲击能力差,且不耐温急变; 金属材料耐碱、耐高温、耐热、耐溶剂,且机械强度高,但不耐酸; 而有机高分子材料耐酸碱盐,但不耐溶剂而机械强度低。 这些材料的优缺点各不相同,因此通常复合以构成复合材料(Composite material)。 常见的复合材料有钢筋混凝土(无机非金属+金属材料)与玻璃纤维(无机非金属+有机高分子材料)等。
本文主要研究有机材料和经典金属材料的性质。
有机高分子材料
有机高分子材料是由许多以共价键相连且重复的单体(monomer)或结构单元(structural unit)组成分子量很大的化合物。 这种化合物——通称塑料——是许多现代材料的基础。
高分子材料的重要参数是玻璃化温度(Glass transition temperature)。 高分子材料等非晶体材料在加热时会发生类似相变的变化,一般这种材料在较低温度下具有类似玻璃的光滑物理形态,称为玻璃态。 逐渐加热后,则会逐渐具有弹性,这种状态称为高弹态。 进一步加热后,材料则会逐渐表现为具有黏性的流体,这种状态称为粘流态。 由高弹态冷却向玻璃态转化的温度,则称为玻璃化温度。
注意,和晶体的相变不同,非晶体发生状态转换时,不具有固定的温度。 因此,玻璃化温度通常是根据一定的约定而定义的。
有机高分子材料中,经典的两种是聚苯乙烯和聚乙烯。
聚苯乙烯
聚苯乙烯(Polystyrene,PS)是苯乙烯加成聚合而形成的高聚物。 聚苯乙烯易被强酸强碱腐蚀,可以被多种有机溶剂溶解,如丙酮、乙酸乙酯,但不吸水,能防潮; 其不抗油脂,受到紫外光照射后易变色;质地硬而脆,无色透明,可以和多种染料混合产生不同的颜色。 聚苯乙烯的玻璃化温度高于一百摄氏度,因此常被用于制作盛沸水的容器。
苯乙烯除了自加聚形成聚苯乙烯外,还可与丙烯腈(Acrylonitrile)和丁二烯(Butadiene)形成共聚物,即ABS塑料。 这种塑料的分子量在5万至20万不等。
聚苯乙烯无法经由生物降解及光分解进入生物地质化学循环,不易分解和霉变,但因此也容易造成环境污染。 近年来,在面包虫的消化道中发现了一种细菌,可完成聚苯乙烯的分解。
聚乙烯
聚乙烯(Polyethylene,PE)是乙烯加成聚合而形成的高聚物。 聚乙烯的化学耐受度高,几乎不与强酸强碱反应,且能够耐受一般的氧化剂和还原剂。 然而,其物理性能较差,具有较高的延展性,但力学性能低,不耐压。 此外,聚乙烯不耐紫外线,会在紫外线下更快地分解。
聚乙烯根据加聚的压力与成品的密度不同,主要分为高密度聚乙烯(High Density Polyethylene, HDPE)和低密度聚乙烯(Low Density Polyethylene, LDPE)两种。 前者在中压下加聚,形成的支链较少,因此分子间作用力较强,比强度较高; 后者在高压下加聚,形成的支链较多,因此分子间作用力较弱,比强度较低,但是弹性能高。
金属材料
金属材料中,合金是一类常见的材料,通过混合多种金属,可以取得更加优秀的性能。 而最古老的合金是青铜,一种铜、锡和铅为主组成的合金。
青铜的组分依地区和时间的变化而不同,典型的组分为60%的铜、25%的锡与15%的铅。 由于锡的加入,青铜的熔点仅为810摄氏度,远低于红铜(纯铜)的1084摄氏度。 加入的铅则可改变合金的流动性,使其易于加工。
除青铜外,另两种经典的金属材料是铝与钢。
铝的提炼
在金属元素中,铝在地壳中的含量最大,且延展性好,抗腐蚀能力高。 然而,由于铝单质难以还原,因此其在地壳中并不以游离态单质存在,且加工温度高,因此难以提炼与使用,其大规模使用远远晚于其他经典的金属材料。
铝的提炼主要分为两个部分: 首先,铝土矿(主要成分为氧化铝)通过拜耳法提纯为纯氧化铝; 然后,通过霍尔-埃鲁法还原为铝单质。
拜耳法
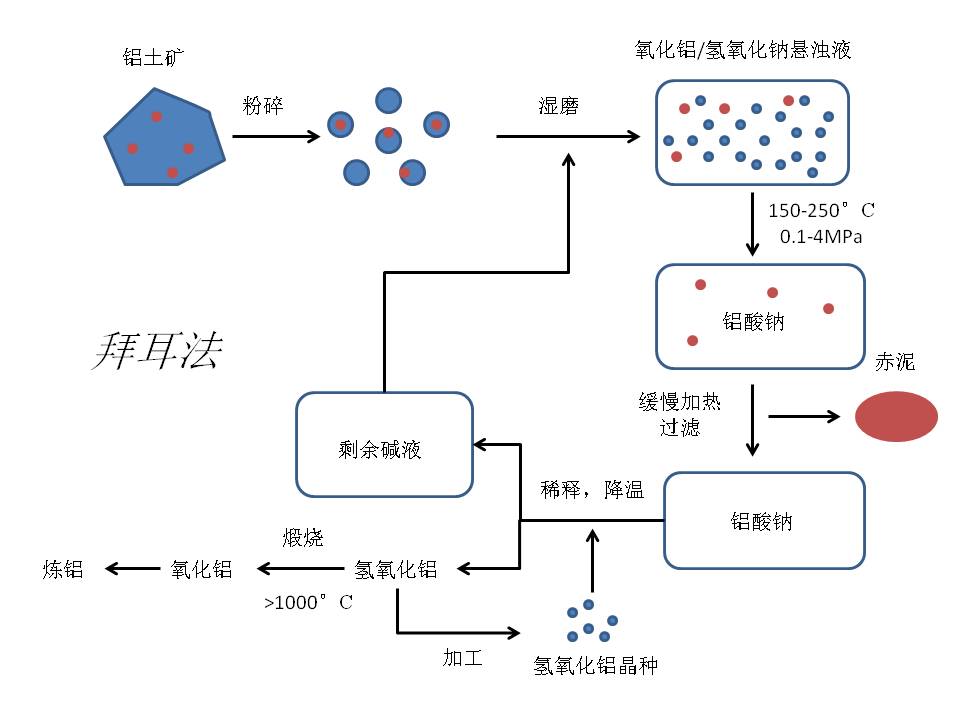
拜耳法主要利用偏铝酸来进行分离,其主要分为以下几步:
- 氧化铝与热的浓氢氧化钠溶液反应,生成偏铝酸钠,化学反应方程式为 \(\mathrm{Al_2O_3} + 2 \text{NaOH} = 2 \mathrm{NaAlO_2} + \mathrm{H_2O}\) 然后过滤,此步中大部分不溶解的杂质被滤除,由于铁离子的存在,杂质一般呈红色,从而称为“赤泥”。
- 冷却溶液,使偏铝酸钠过饱和。加入晶种(若有必要)并结晶,得到氢氧化铝晶体。
- 煅烧氢氧化铝,使其分解并形成氧化铝。
第一步中二氧化硅会被溶解生成硅酸钠$\mathrm{Na_2SiO_3}$,硅酸钠能进一步反应生成水合铝硅酸钠并沉淀,从而被分离。 第二步中的晶种通常仅需要在第一次结晶时加入。
霍尔-埃鲁法
霍尔法通过点解熔融氧化铝来制取铝单质,总的化学反应式为 \(2 \mathrm{Al_2O_3} \xlongequal[\mathrm{Na_3AlF_6}]{\text{电解}} 4 \mathrm{Al} + 3 \mathrm{O_2} \uparrow\)
通过在氧化铝中加入冰晶石,可降低其熔点,使反应能够在950-970摄氏度左右发生。
实际生产中,电解阴极通常使用石墨,而阳极则使用焦炭,此时氧气会被还原为二氧化碳。
炼铁与炼钢
炼铁前,我们首先研究常见的铁矿石的特点。
| 中文名 | 英文名 | 主要化学成分 | 特点 |
|---|---|---|---|
| 磁铁矿 | Magnetite | $\text{Fe}_3\text{O}_4$ | 有铁磁性 |
| 赤铁矿 | Hematite | $\text{Fe}_2\text{O}_3$ | |
| 褐铁矿 | Limomite | $\text{FeO(OH)}$, $m \text{Fe}_2\text{O}_3 \cdot n \text{H}_2\text{O}$ | |
| 菱铁矿 | Siderite | $\text{FeCO}_3$ |
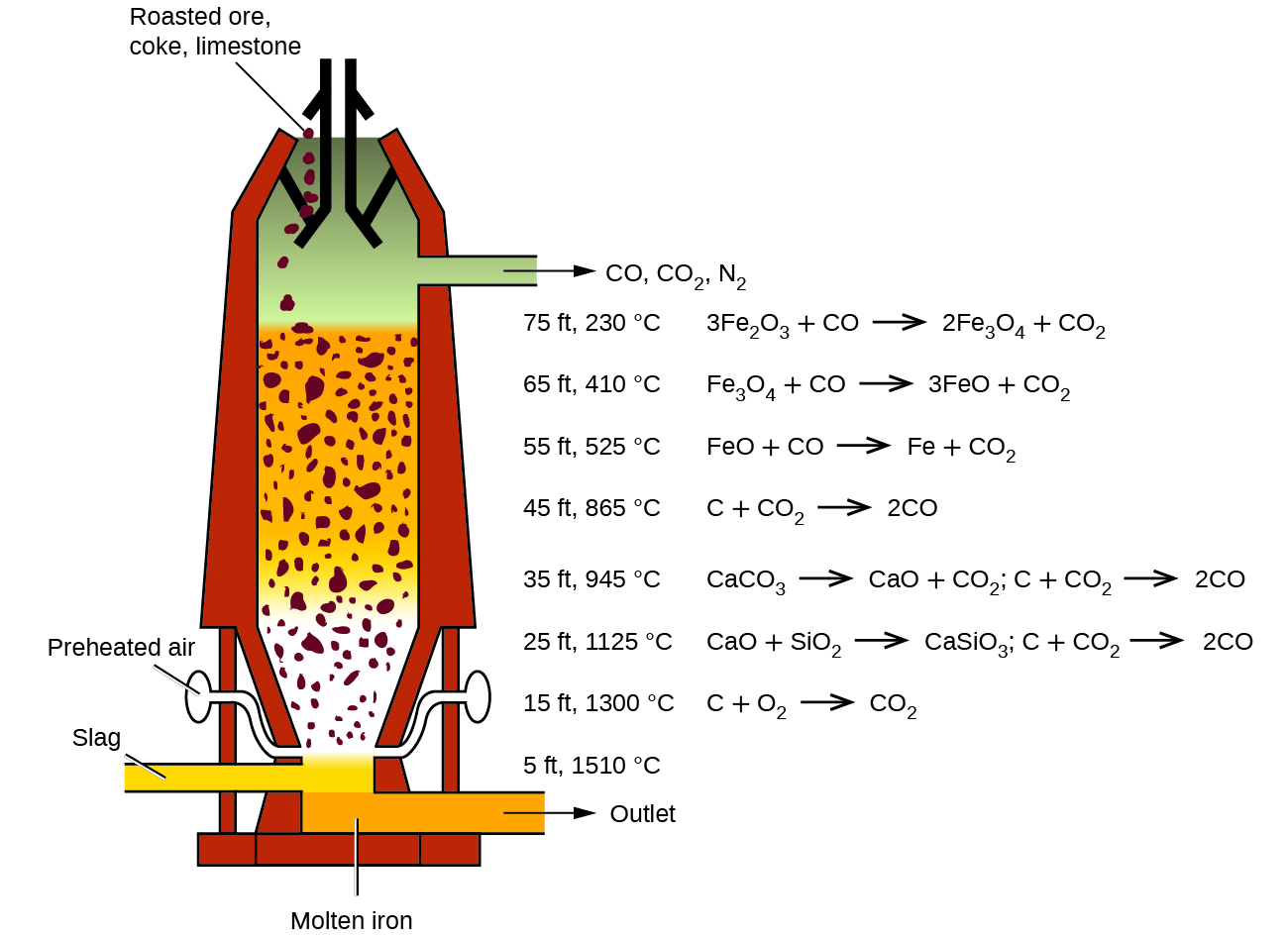
炼铁通常是在高炉(Blast furnace)中进行的,主要发生三种反应:
- 焦炭完全燃烧,生成二氧化碳;
- 二氧化碳被碳还原,生成一氧化碳;
- 一氧化碳逐步还原铁的氧化物,形成液态铁单质。
铁矿中的主要杂质,即二氧化硅与硅酸盐等,熔点和密度均小于铁,因此形成液态的炉渣(Slag),并从高炉中排出。 高炉中通常直接通入预热过的空气,其中的氮气可降低反应速率,防止碳剧烈燃烧且生成大量气体导致爆炸。
炼钢则一般是通过转炉(Bessemer converter)完成的,该方法最初由中国发明,以英国人亨利·贝塞麦的名字命名。 但最初用于大规模工业生产的过程实际上是平炉炼钢法,直到上世纪五十年代提出了将纯氧注入转炉中的改良工艺,该方法才最终用于钢的大规模生产。 该方法原理非常简单,即直接向炼制的铁水中注入纯氧,从而氧化其中的碳,降低碳含量,制成铁碳合金。
铁碳合金
在研究铁碳合金之前,我们首先考虑铁的结构。 固态的纯铁具有三个相:α相、γ相与δ相,三者的晶体结构分别为体心立方、面心立方与体心立方。
在高中的化学选修中我们学习过,面心立方与体心立方的配位数和致密度分别为$12, 74\%$和$8,68\%$,这意味着,理论上,属于体心立方的α相与δ相似乎更容易渗入碳从而形成合金。 然而,应当注意到,面心立方晶系中,晶胞中央的空格更加集中,而体心立方晶系虽然致密度更低,空闲的空间却均匀地分布在晶胞中,因此难以容下碳原子。 实际上,属于面心立方的γ相铁更加容易形成合金。
匀晶与共晶相图
为更进一步的研究铁与碳混合体系中的相及其变化,我们需要研究一般的混合系统的相。 我们首先给出组分与相的定义。
系统中组成、结构相同,性能一致的均匀组成部分称为相(Phase); 系统中能够单独分离出来,并能稳定存在的纯物质称为组元或组分(Component)。
在一般的混合系统中,自由度可通过吉布斯相律计算:
一般混合系统的自由度由以下多线性关系决定: \(F = C - P + n,\) 其中$C$表示系统中的组分数、$P$表示系统中的相数、$n$表示约束数,一般的相变中,由于温度和压力固定,通常取二;对固体和固液相变,若压力影响不大,则可取一。
以液体的蒸馏为例,简单的计算表明自由度为二,这意味着系统可以位于一个平面上的任意一点,其相图具有以下形式:
该相图上可利用物料衡算得出杠杆规则:
设某一温度下维持平衡的双组分系统中甲组分的摩尔分数为$x$,乙组分的摩尔分数为$1-x$,则系统中甲组分摩尔分数为$x_1$和$x_2$的两相的摩尔数满足 \(\frac{n_1}{n_2} = \frac{x_2 - x}{x - x_1},\) 其中$n$表示该相中甲乙两组分总的物质的量。
在相图上,这形似一根杠杆,因此得名,在上图中以绿色标识。 杠杆规则中的物质的量也可替换为质量。
在固液相变中,相图也可具有相同的形式。 从液体析出结晶的转变可分为三种:
- 匀晶转变(Isomorphous transformation):在固相和液相均可互溶的两组分,从一种液相转化为一种固相的转变,可记为$L \to \alpha$;
- 共晶转变(Eutectic transformation):两组分中一种液相同时产生两种固相的转变,可记为$L \to \alpha + \beta$;
- 包晶转变(Peritectic transformation):固液物中的固相和周围的液相转变成一种新的固相的转变,可记为$L + \alpha \to \beta$。
除此之外,固相也可以发生共析转变,即一种固相析出两种固相的转变,可记为$\alpha \to \beta + \gamma$。
若混合系统在相变时发生且仅发生匀晶转变,即固态和液体均可完全互溶,则其相图与蒸馏时的相图相同,这种相图称为匀晶相图。 若混合系统仅在液态可互溶,而在固态不可完全互溶,则可能发生多种转变,这种相图称为共晶相图。
共晶相图中,重要的点是共晶点(Eutetic point)。 在该组分下逐渐冷却系统,形成的合金称为共晶合金;否则,若合金中主要组分的分数较低,则称为亚共晶合金;反之称为超共晶合金。
一般的相图可能是多个相图的组合,如铁碳合金的相图就是典型的共晶相图的组合。
图中的C点即为共晶点; 相对地,J点发生匀晶转变,称为匀晶点; S点发生共析转变,称为共析点。
铁碳相图中的几种相分别具有不同的名字:
- 奥氏体(Austenite),即γ相的铁,溶碳能力较大,强度低,可塑性强,膨胀灵敏,无磁性,有一定韧性;
- 铁素体(Ferrite),即α相的铁,溶碳能力很低,具有良好的塑性和韧性,但强度和硬度都很低;
- 渗碳体(Cementite),即碳化三铁,硬度很高,但脆性极大;
- 珠光体(Pearlite)是铁素体与渗碳体的混合物;
- 莱氏体(Ledeburite)是奥氏体与渗碳体的混合物。
渗碳体对钢的强度影响很大,其形状与分布能影响钢的性质,因此碳的质量分数是钢的重要指标。 若铁碳合金中碳含量过高(一般指$> 2\%$),则渗碳体组分更多,形成的合金较脆,易于铸造而难于锻造,故称为铸铁(Cast iron),碳含量较低的合金则称为钢(Steel)。 碳含量等于$0.8 \%$时,在冷却时合金经过共析点,这种钢称为共析钢(Eutectoid steel),碳含量更低的钢称为亚共析钢;反之则称为过共析钢。
金属的腐蚀
金属的腐蚀指金属材料受到介质作用,发生状态变化,产生新的相,从而遭受破坏的现象。 一般情况下的金属腐蚀是金属充当阳极(负极)的原电池反应。 我们可从化学反应热力学的角度研究该现象。
腐蚀反应的热力学考虑
我们知道,恒温恒压的热力学系统的非体积功能量变化可由吉布斯自由能变表示。 又因为在原电池中,所有非体积功均变为电动势,从而根据能量衡算,有 \(\Delta G = - n F \Delta E \iff \Delta G^0 = - n F \Delta E^0,\) 其中$n$是电子个数,$F$是法拉第常数,$\Delta E$是原电池两极的平衡电位差,上标$0$表示标准状态,这种数值可通过查表得出。 这意味着电化学腐蚀是否发生,可以通过原电池的电位差来判定。
根据标准吉布斯反应能的关系,我们有 \(\Delta G = \Delta G^0 + RT \ln Q,\) 其中$Q$是反应商,在平衡状态下,其值等于反应平衡常数$K$。 在电化学反应中,反应商通常使用活度(Activity)而非浓度计算,此时$Q$也被称为活度商。
再带入上式,可得能斯特方程。
电极上,标准电极电势$E^0$与指定氧化还原对的平衡电压$E$之间满足能斯特方程(Nernst equation): \(E = E^0 - \frac{RT}{nF} \ln K,\) 该方程同时应用于单个电极上的反应与整个原电池的反应。
利用能斯特方程,在知道电极的电势与发生的反应的情况下,自然可以得出平衡状态下发生反应的各组分的活度商,从而可以确定各组分的浓度。 利用这些浓度,我们可以确定一种特定的电极在,某一状态下,发生电化学反应后的产物的主要组成部分。 在某一金属与水接触发生腐蚀的情况下,一般水中的氢离子或氢氧根会参与反应,因此利用电势和pH值,即可确定腐蚀的产物,这种图称为布拜图(Pourbaix Diagram)。 纵轴电势是电极相较于标准氢电极的电势,有时也可用电子浓度的负对数(pE)表示,因此,布拜图的左下角表示强酸性、强还原性环境;而右上角则表示强碱性、强氧化性环境。
布拜图中,由直线分割开的区域表示该平衡状态下的物质的主要组分,而直线则代表了两种组分之间的反应。 直线上的点表示在化学反应平衡时,直线两侧的物质浓度相等。 特别地,纯的氧化还原反应的电极电势不受氢离子浓度影响,因此一般是横线,而纯的仅有氢离子参加的酸碱中和反应则不发生电子交换,因此是竖线。 由于化学反应的平衡还会因温度、压强与浓度等变化,布拜图中必须标明体系所处的温度、压强与溶质的浓度。 一般情况下,温度取室温、压强取一个大气压而溶质的浓度为一摩尔每升或$10^{-6}$摩尔每升。
铁的布拜图中,根据产物的不同,可分为三个区:
- 产物为铁:铁能稳定存在,不发生腐蚀,该区称为免蚀区(Protection region);
- 产物为其他固体:固态的产物能阻碍腐蚀的发生,该区称为钝化区(Passivation region);
- 产物为水溶性物质:铁会被腐蚀,该区称为腐蚀区(Corrosion region)。
根据以上三个分区,可制订两种保护铁的策略:
- 钝化处理:通过提前钝化铁来进行保护,通常指烤蓝或刷漆等;
- 阴极保护:通过降低铁的电位,使其变为阴极来进行保护,通常包括牺牲阳极的阴极保护和外加电流的阴极保护两种。
始终注意,以上考虑都是热力学角度上的,即只能确定反应是否发生,而不能确定反应发生的速度。
腐蚀反应的动力学考虑
在腐蚀反应的动力学中,对其反应速度有重大影响的一种效应称为极化(Polarization),这是指当有电流通过时,原电池中电极的电势与可逆情况时(未通电时)不同,从而导致电极电势偏离的现象。 极化现象通常可分为以下两种:
- 活化极化(Activation polarization):电化学反应的产物在电极和电解质界面上堆积,形成双电层,导致电极电势发生变化。在金属腐蚀中,这是金属离子进入溶液的速率小于电子进入电极的速率而产生的,这会导致阳极金属离子堆积,从而使其电位升高。
- 浓差极化(Concentration polarization):已经进入电解质的离子,由于扩散速度较慢而堆积在电极附近,导致电极附近离子浓度较高,从而阻碍离子的溶解。
在电解池和原电池中,极化现象具有不同的表现,但是通常总是阻碍电化学反应的进一步发生。 在金属腐蚀这一原电池反应中,极化导致金属阳极(负极)的电位升高,原电池的电动势降低,从而阻碍腐蚀的进一步发生。
极化对反应的影响可从埃文斯图(Evans diagram)中读出。 埃文斯图是电极的电势与电流之间的关系图,图中直线的斜率表示了电流对电势的极化影响,从而称为极化率。
上图展示了铁阴极($\text{Fe} \to \text{Fe}^{2+} + 2e^-$)与某一阳极的埃文斯极化图。 若我们希望尽量降低电流而缓解腐蚀,则可通过调整电势或提高极化率两种方式实现。